Качество питательной воды
Качество питательной воды влияет на надежную и экономичную работу котельной установки и питания котлов.
Источниками водоснабжения для питания котлов могут служить пруды, реки, озера, а также грунтовые или артезианские воды, городской или поселковый водопровод. Природные воды, обычно содержат примеси в виде растворенных солей, коллоидные и механические примеси, поэтому непригодны для питания паровых котлов без предварительной очистки.
Водные растворы твердых веществ. Твердые вещества, содержащиеся в воде, разделяют на механически взвешенные примеси, состоящие из минеральных и иногда органических частиц, коллоидно-растворенные вещества и истинно растворенные вещества. Количество вещества, растворенного в единице раствора (воде), определяет концентрацию раствора и обычно выражается в миллиграммах на килограмм раствора (мг/кг).
Вода, как и всякая жидкость, может растворять только определенное количество того или иного вещества, образуя при этом насыщенный раствор, а избыточное количество вещества остается в нерастворенном состоянии и выпадает в осадок.
Различают вещества, хорошо и плохо растворимые в воде. К веществам, хорошо растворимым в воде, относят хлориды (соли хлористоводородной кислоты) СаСl2, MgCl2, NaCl, к плохо растворимым - сульфиды (соли серной кислоты) CaSO4, MgSО4, NaSО4 и силикаты (соли кремниевой кислоты) CaSi03, MgSiО3. Присутствие сульфидов и силикатов в воде приводит к образованию твердой накипи на поверхности нагрева котлов.
Растворимость веществ зависит от температуры: жидкости, в которой они растворяются. Различают вещества, у которых растворимость увеличивается с ростом температуры, например СаСl2, MgCl2, Mg(NО3)2, Ca(NО3)2, и у которых уменьшается, например CaSО4, CaSiО3, MgSiО3.
В частности, при нагревании воды до 70 - 75°С начинается термический распад хорошо растворимых бикарбонатов капьция и магния с переходом в плохо растворимые карбонаты и гидраты по реакциям:
СaCO3 + H2O + CO2 ↔ Ca(HCO3)2 ↔ Ca2+ +2HCO3; (1)
MgCO3 +H2O +CO2 ↔ Mg (HCO3) ↔ Mg2+ + 2HCO3;
FeCO3 + H2O +CO2 ↔ Fe(HCO3)2 ↔ Fe2+ + 2HCO3.
При дальнейшем нагреве воды в паровом котле до 200°С и выше могут возникнуть и другие реакции, например
CaSO4 + Na2CO3 = CaCO3 + NaSO4 (2)
Большинство твердых веществ, растворимых в воде, представляет собой электролиты, т. е. вещества, молекулы которых в водной среде распадаются на ионы, атомы или группу атомов, несущих электрический заряд. Молекула электролита распадается на два иона. Один из них имеет положительный заряд, называется катионом и обозначается знаком " + ",
Другой имеет отрицательный заряд, называется анионом и обозначается знаком " - ". Металлы, входящие в молекулу электролита (магний Mg, кальций Са, железо Fe), становятся катионами, а металлоиды (хлор Сl, сера S) - анионами. При этом вода как электролит является всегда электрически нейтральной, поскольку сумма положительно заряженных ионов - катионов всегда равна сумме отрицательно заряженных ионов - анионов.
Обычно в природной воде присутствуют катионы Са2+, Mg2+ + Na, Fe2+ и анионы НСО-3 + Cl-, SО-2, S12-3. В слабых растворах на ионы распадается все количество электролита, растворенное в воде, в более концентрированных растворах - только часть растворенного электролита. Количество растворенного в воде электролита называется степенью электролитической диссоциации.
Газовые растворы. В неочищенной, так называемой сырой воде, обычно растворены азот, кислород, двуокись углерода и сероводород. Все они нежелательны, но особенно вредными являются коррозионно-активные газы: кислород и двуокись углерода. Кислород, попавший в котельный агрегат и трубопроводы, непосредственно вступает в реакцию с металлом. Газы имеют различную растворимость, которая всегда уменьшается с повышением температуры жидкости. При температуре кипения жидкости газы полностью теряют способность растворяться. Степень растворимости в воде при атмосферном давлении кислорода, двуокиси углерода и сероводорода приведена в табл. 1. Согласно закону Генри концентрация газа, растворенного в жидкости, прямо пропорциональна давлению газа над раствором.
Таблица 1 Содержание растворенных газов, мг/кг, в зависимости от температуры жидкости
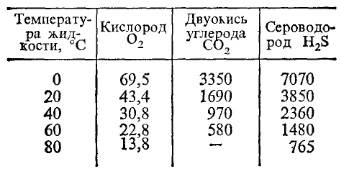
Примечание. При температуре жидкости 100°С и выше кислород, двуокись углерода и сероводорот отсуствуют.
Показатели качества воды. Качество питательной воды характеризуется прозрачностью (содержанием взвешенных веществ), сухим остатком, жесткостью, щелочностью, окисляемостью. Сухой остаток содержит общее количество растворенных в воде веществ : кальция, магния, натрия, аммония, железа, алюминия и др., которые остаются после выпаривания воды и высушивания остатка при 110°С.
Сухой остаток выражают в миллиграммах на килограмм или в микрограммах на килограмм.
Жесткость питательной воды характеризуется суммарным содержанием в воде солей кальция и магния, являющихся накипеобразователями. Различают жесткость общую, временную (карбонатную) и постоянную (некарбонатную).
Общая жесткость представляет собой сумму величин временной и постоянной жесткости и характеризуется суммой содержания в воде кальциевых и магниевых солей: сернокислых (CaSО4 и MgSO4), хлористых (СаСl2 и MgCl2), азотнокислых (Ca(NО3)2 и Mg(NО3)2), кремнекислых (CaSiO3 и MgSiО3), фосфорнокислых (Са3(РО4)2 и Mg(PО4)2), двууглекислых.
Временная жесткость характеризуется содержанием в воде бикарбонатов кальция и магния Са(НСО3)2 и Mg(HCО3)2. Постоянная жесткость обусловливается содержанием указанных выше солей кальция и магния, за исключением двууглекислых.
Для определения величины жесткости в настоящее время установлена согласно ГОСТ 6055-51 единица показателя жесткости - миллиграмм-эквивалент на 1 кг раствора (мг-экв/кг) или микрограмм-эквивалент на 1 кг раствора (мкг-экв/кг); 1 мг-экв/кг жесткости соответствует содержанию 20,04 мг/кг иона кальция Са2 + или 12,16 мг/кг иона магния Mg2 +.
Общая жесткость воды, мг-экв/кг, выражается суммарной концентрацией в воде катионов Са2 + (кальциевая жесткость) и Mg2+ (магниевая жесткость)
Жо=Ca2+ / 20.04 + Mg2+ / 12,16 (3)
где Са2 + и Mg2 + - концентрация в воде соответственно катионов кальция и магния, мг/кг; 20,04 и 12,16 - соответственно их эквивалентные массы, мг-экв/кг.
Карбонатная жесткость, мг-экв/кг,
Жк = HCO3- / 61,02 (4)
где НСО3- - концентрация в воде соответственно анионов бикарбонатов кальция и магния, мг/кг; 61,02 - их эквивалентная масса, мг-экв/кг.
Постоянная (некарбонатная) жесткость, мг-экв/кг,
Жп = Жо - ЖК (5)
Эквивалентная масса равна молекулярной массе вещества, деленной на его валентность.
В качестве примера приведена табл. 2 эквивалентных масс солей жесткости.
Таблица 2. Эквивалентные массы солей жесткости
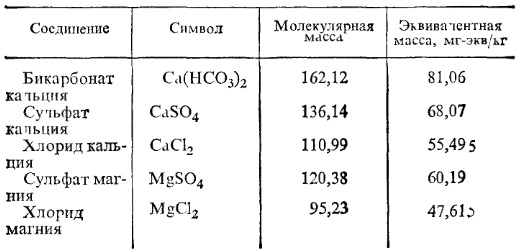
Щелочность воды характеризуется содержанием в ней щелочных соединений. Сюда относят гидраты, например NaOH - едкий натр, карбонаты Na2CО3 - кальцинированная сода, бикарбонаты NaHСO3, Na3PО4 и др. Величина щелочности воды равна суммарной концентрации в ней гидроксильных, карбонатных, бикарбонатных, фосфатных и других анионов слабых кислот, выраженной в эквивалентных единицах (мг-экв/кг или мкг-экв/кг). В зависимости от преобладающего наличия в воде анионов тех или иных солей различают щелочность: гидратную (концентрация в воде гидроксильных анионов ОН), карбонатную (концентрация карбонатных анионов СО2-3) и бикарбонатную (концентрация бикарбонатных анионов НСО3-3).
Окисляемость характеризуется наличием в воде кислорода и двуокиси углерода, выраженных в миллиграммах или микро¬граммах на килограмм.
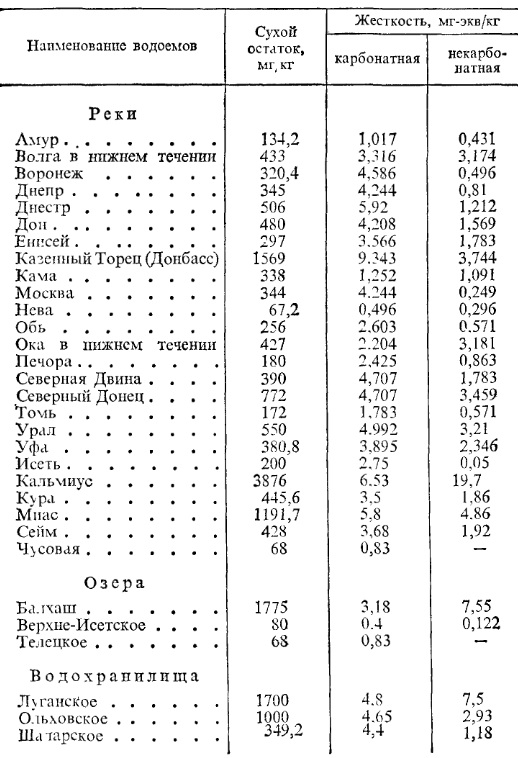
Данные о составе некоторых речных вод России приведены в табл. 3.
Т а б л и ц а 3. Данные анализов воды некоторых рек и водоемов России
Вода, подготовленная для питания котельной установки, не должна давать отложений шлама и накипи, разъедать стенки котла и его вспомогательные поверхности нагрева, а также вспениваться.
Общие понятия о водном режиме паровых котлов. В питательной воде, поступающей в котел, независимо от того, каким способом производилось ее умягчение, всегда остается какая-то часть примесей.
В процессе получения пара и отвода его из котла, а также поступления в котел все новых порций питательной воды в котловой воде увеличивается количество солей, так как сухой пар не растворяет их.
При увеличении содержания солей в котловой воде выше нормы начнется выпадение их в осадок и образование накипи на поверхности нагрева и шлама в толще воды, появится ценообразование и усилится унос паром котловой воды с растворенными в ней солями, что приведет к заносу паропровода и паропотребляющих устройств солями. Поэтому для надежной работы котельной установки недостаточно только очистки питательной воды, необходимо обеспечить также нормальный внутрикотловой режим, заключающийся в поддержании состава котловой воды в пределах установленных норм. Для получения пара нужного качества котловая вода обрабатывается специальными реагентами, которые заставляют накипеобразующие соли выпадать в котле в виде шлама, легко удаляемого продувкой.
Требования к качеству насыщенного пара в котлоагрегатах приведены в табл. 4.
Таблица 4 Требования к качеству насыщенного пара
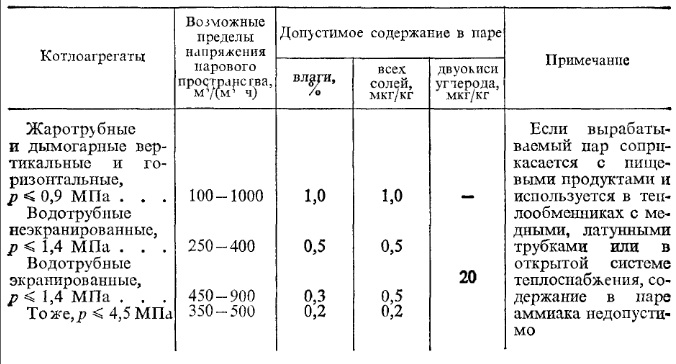
Для паровых турбин качество пара должно быть еще выше, оно регламентировано Правилами технической эксплуатации электростанций и сетей (ПТЭ).
Требования к качеству питательной и котловой воды для производственных и отопительных котельных приведены в табл. 5 и 6.
Для водогрейных котлов качество питательной воды должно удовлетворять следующим требованиям: карбонатная жесткость не более 700 мкг-экв/кг, содержание растворенного кислорода - 50 мкг/кг, взвешенных веществ - 5 мкг/кг, содержание свободной двуокиси углерода не допускается, значение показателя pH не менее 7. Значение pH характеризует концентрацию ионов водорода в растворе. Последнее требование означает, что реакция воды должна быть либо нейтральной (pH = 7), либо щелочной (pH > 7).
Таблица 5. Требования к качеству питательной воды котлоагрегатов
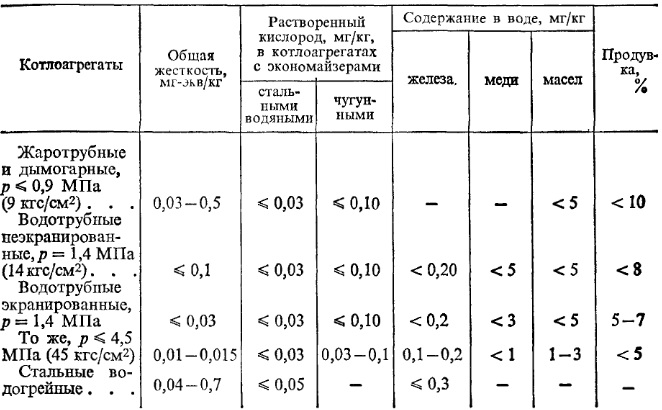
Таблица 6. Требования к качеству котловой воды
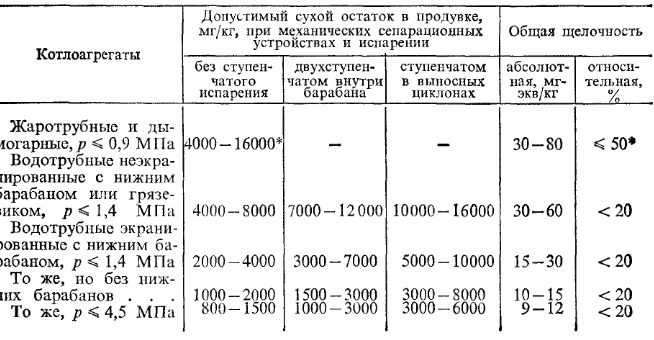
При внутрикотловой обработке воды.
Расход воды в котельных установках. Вода, поступающая в отопительные и производственные котельные из водопровода, артезианских скважин или водоемов, расходуется на восполнение потерь сетевой воды, конденсата, пара и собственные нужды котельной установки, включая техническое водоснабжение.
В водогрейных котельных установках вода теряется при обмывке поверхностей нагрева, деаэрации, разогреве мазута, утечках через неплотности, а также в системах теплоснабжения.
При открытой системе теплоснабжения к потерям добавляется расход воды на горячее водоснабжение потребителей.
В паровых котельных установках потери воды происходят за счет расхода части пара на собственные нужды (привод насосов, подогрев и распыливание мазута, продувку котлоагрегатов, обдувку и очистку его поверхностей нагрева, утечки через неплотности) и других расходов. Кроме потерь пара теряется и его конденсат. При снабжении потребителей паром часть конденсата теряется из- за загрязнения в результате несовершенства теплообменных аппаратов, а иногда из-за технологического процесса без возврата конденсата. Расходы воды возмещают в специальных устройствах, комплекс которых называют водоподготовительной установкой.





















































